Biofilmy jsou souborem jednoho nebo více typů mikroorganismů, které mohou růst na mnoha různých površích. Mikroorganismy, které tvoří biofilmy, zahrnují bakterie, houby a protisty.
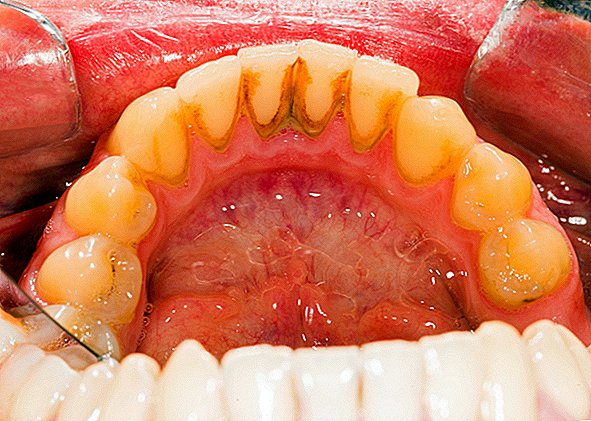
Jeden běžný příklad zubního plaku z biofilmu, slizký nahromadění bakterií, které se tvoří na površích zubů. Dalším příkladem je rybník. Bylo zjištěno, že biofilmy rostou na minerálech a kovech. Byly nalezeny pod vodou, pod zemí a nad zemí. Mohou růst na rostlinných tkáních a živočišných tkáních a na implantovaných zdravotnických zařízeních, jako jsou katétry a kardiostimulátory.
Každý z těchto odlišných povrchů má společný definující znak: jsou mokré. Podle článku z roku 2007 zveřejněného v časopisu Microbe Magazine jsou tato prostředí „periodicky nebo trvale zatížena vodou“. Biofilmy se daří na vlhkých nebo mokrých površích.
Biofilmy se v takových prostředích etablovaly velmi dlouhou dobu. Podle článku z roku 2004 publikovaného v časopise Nature Reviews Microbiology je fosilní důkaz o biofilmech asi před 3,25 miliardami let. Například biofilmy byly nalezeny v 3,2 miliardiletých hlubinných hydrotermálních horninách Pilbara Craton v Austrálii. Podobné biofilmy se vyskytují v hydrotermálních prostředích, jako jsou horké prameny a hlubinné průduchy.

Tvorba biofilmu
Tvorba biofilmu začíná, když volně plovoucí mikroorganismy, jako jsou bakterie, přicházejí do styku s vhodným povrchem a začnou tak říkat kořeny. Tento první krok připojení nastává, když mikroorganismy produkují gooey látku známou jako extracelulární polymerní látka (EPS), podle Centra pro biofilmové inženýrství na Montana State University. EPS je síť cukrů, bílkovin a nukleových kyselin (jako je DNA). Umožňuje mikroorganismům v biofilmu držet se spolu.
Po připojení následuje období růstu. Na prvních vrstvách se staví další vrstvy mikroorganismů a EPS. Podle Centra pro biofilmové inženýrství nakonec vytvoří baňkovitou a komplexní 3D strukturu. Vodní kanály křižují biofilmy a umožňují výměnu živin a odpadních produktů, podle článku v Mikrobu.
Mnohé podmínky prostředí pomáhají určit rozsah, v jakém biofilm roste. Tyto faktory také určují, zda je vyroben pouze z několika vrstev buněk nebo z podstatně více. "To záleží na biofilmu," řekl Robin Gerlach, profesor na katedře chemického a biologického inženýrství na Montanské státní univerzitě v Bozemanu. Například mikroorganismy, které produkují velké množství EPS, mohou vyrůst v poměrně silné biofilmy, i když nemají přístup k mnoha živinám, řekl. Na druhé straně, pro mikroorganismy, které jsou závislé na kyslíku, může dostupné množství omezit, jak mohou růst. Dalším faktorem prostředí je koncept „smykového napětí“. „Pokud máte velmi vysoký průtok biofilmem, jako je tomu u potoka, biofilm je obvykle docela tenký. Pokud máte biofilm v pomalu tekoucí vodě, jako v rybníku, může být velmi hustý,“ vysvětlil Gerlach.
Nakonec mohou buňky v biofilmu opustit záhyb a usadit se na novém povrchu. Buď se odtrhne shluk buněk, nebo jednotlivé buňky propuknou z biofilmu a hledají nový domov. Podle Centra pro biofilmové inženýrství je tento proces znám jako „očkovací disperze“.
Proč tvořit biofilm?
U mikroorganismů má život jako součást biofilmu určité výhody. „Komunity mikrobů jsou vůči stresu obvykle odolnější,“ řekl Gerlach Live Science. Mezi potenciální stresory patří nedostatek vody, vysoké nebo nízké pH nebo přítomnost látek toxických pro mikroorganismy, jako jsou antibiotika, antimikrobiální látky nebo těžké kovy.
Existuje mnoho možných vysvětlení pro odolnost biofilmů. Například, slizký EPS kryt může působit jako ochranná bariéra. Může pomoci zabránit dehydrataci nebo působit jako štít proti ultrafialovému (UV) světlu. Také škodlivé látky, jako jsou antimikrobiální látky, bělidlo nebo kovy, jsou při styku s EPS buď vázány nebo neutralizovány. Podle článku z roku 2004 v časopisu Nature Reviews Microbiology jsou tedy zředěny na koncentrace, které nejsou smrtelné, dříve, než se dostanou do různých buněk hluboko v biofilmu.
Přesto je možné, aby některá antibiotika pronikla do EPS a pronikla do vrstev biofilmu. Zde se může objevit další ochranný mechanismus: přítomnost bakterií, které jsou fyziologicky nečinné. Aby fungovala dobře, všechna antibiotika vyžadují určitou úroveň buněčné aktivity. Pokud tedy bakterie začínají fyziologicky spící, antibiotikum naruší mnoho.
Dalším způsobem ochrany proti antibiotikům je přítomnost speciálních bakteriálních buněk známých jako „perzistující“. Takové bakterie se nerozdělují a jsou odolné vůči mnoha antibiotikům. Podle článku z roku 2010 zveřejněného v časopise Cold Spring Harbor Perspectives in Biology, „persisters“ fungují tak, že produkují látky, které blokují cíle antibiotik.
Obecně platí, že mikroorganismy žijící společně jako biofilm těží z přítomnosti svých různých členů komunity. Gerlach citoval příklad autotrofních a heterotrofních mikroorganismů, které spolu žijí v biofilmech. Autotrofy, jako jsou fotosyntetické bakterie nebo řasy, jsou schopny produkovat vlastní potraviny ve formě organických materiálů (obsahujících uhlík), zatímco heterotrofy nemohou produkovat vlastní potraviny a vyžadují vnější zdroje uhlíku. „V těchto komunitách s více organizmy často kříží potravu,“ řekl.
Biofilmy a nás
Vzhledem k široké škále prostředí, ve kterých se setkáváme s biofilmy, není divu, že ovlivňují mnoho aspektů lidského života. Níže uvádíme několik příkladů.

Zdraví a nemoc
Jak výzkum v průběhu let pokročil, byly biofilmy - bakteriální a plísňové - zapojeny do různých zdravotních stavů. Ve výzvě k předkládání žádostí o grant z roku 2002 uvedly Národní instituty zdraví (NIH), že biofilmy představují „více než 80 procent mikrobiálních infekcí v těle“.
Biofilmy mohou růst na implantovaných zdravotnických prostředcích, jako jsou protetické srdeční chlopně, kloubní protetika, katétry a kardiostimulátory. To zase vede k infekcím. Tento jev byl poprvé zaznamenán v 80. letech, kdy byly bakteriální biofilmy nalezeny na intravenózních katétrech a kardiostimulátorech. O bakteriálních biofilmech je také známo, že způsobují infekční endokarditidu a pneumonii u osob s cystickou fibrózou, mimo jiné podle článku z roku 2004 v Nature Reviews Microbiology.
„Důvodem, proč je tvorba biofilmu velkým důvodem k obavám, je to, že v rámci biofilmu jsou bakterie odolnější vůči antibiotikům a jiným hlavním dezinfekčním prostředkům, které byste mohli použít k jejich kontrole,“ řekl AC Matin, profesor mikrobiologie a imunologie ve Stanfordu Univerzita. Ve skutečnosti, ve srovnání s volně plovoucími bakteriemi, mohou být ty, které rostou jako biofilm, až 1 500krát odolnější vůči antibiotikům a jiným biologickým a chemickým látkám, podle článku v Mikrobu. Matin popsal rezistenci biofilmu kombinovanou s obecným zvýšením rezistence na antibiotika u bakterií jako „dvojitou whammy“ a hlavní výzvu k léčbě infekcí.
Plísňové biofilmy mohou také způsobit infekce růstem na implantovaných zařízeních. Druhy kvasinek, jako jsou členové rodu Candida rostou na prsních implantátech, kardiostimulátorech a protetických srdečních chlopních podle článku z roku 2014 publikovaného v časopise Cold Spring Harbor Perspectives in Medicine. Candida druhy také rostou na tkáních lidského těla, což vede k onemocněním, jako je vaginitida (zánět vagíny) a orofaryngeální kandidóza (kvasinková infekce, která se vyvíjí v ústech nebo krku). Autoři však poznamenávají, že rezistence na léky nebyla v těchto případech prokázána.
Bioremediace
Biofilmy jsou někdy užitečné. „Bioremediace obecně znamená použití živých organismů nebo jejich produktů - například enzymů - k léčbě nebo degradaci škodlivých látek,“ řekl Gerlach. Poznamenal, že biofilmy se používají při čištění odpadních vod, kontaminantů těžkých kovů, jako je chroman, výbušnin, jako je TNT, a radioaktivních látek, jako je uran. „Mikroby je mohou buď degradovat, nebo změnit jejich pohyblivost nebo toxický stav, a tím je snížit na životní prostředí a člověka,“ řekl.
Nitrifikace pomocí biofilmů je jednou z forem čištění odpadních vod. Během nitrifikace se amoniak oxidací přeměňuje na dusitany a dusičnany. To lze provést autotrofními bakteriemi, které rostou jako biofilmy na plastových površích, podle článku z roku 2013 publikovaného v časopise Water Research. Tyto plastové povrchy mají velikost jen několik centimetrů a jsou rozloženy po vodě.
Výbušný TNT (2,4,6-trinitrotoluen) je považován za znečišťující látku v půdě, povrchové vodě a podzemní vodě. Chemická struktura TNT se skládá z benzenu (hexagonálního aromatického kruhu tvořeného šesti atomy uhlíku) navázaného na tři nitroskupiny (NO)2) a jedna methylová skupina (CH3). Mikroorganismy degradují TNT redukcí podle článku z roku 2007 publikovaného v časopise Applied and Environmental Microbiology. Většina mikroorganismů redukuje tři nitroskupiny, zatímco některé atakují aromatický kruh. Vědci - Ayrat Ziganshin, Robin Gerlach a jeho kolegové - zjistili, že kvasinkové kmeny Yarrowia lipolytica byl schopen degradovat TNT oběma metodami, ale primárně útokem na aromatický kruh.
Mikrobiální palivové články
Mikrobiální palivové články používají bakterie k přeměně organického odpadu na elektřinu. Mikroby žijí na povrchu elektrody a přenášejí na ni elektrony, čímž nakonec vytvářejí proud, řekl Gerlach. Článek z roku 2011 publikovaný v on-line časopisu Illumin, University of Southern California, uvádí, že bakterie poháněné mikrobiálními palivovými buňkami rozkládají jídlo a tělesný odpad. To poskytuje levný zdroj energie a čistou udržitelnou energii.
Průběžný výzkum
Náš svět se hemží biofilmy. Ve skutečnosti v polovině 20. století bylo na vnitřních površích nádob obsahujících bakteriální kultury nalezeno více bakterií, než volně plovoucí v samotné tekuté kultuře, podle článku z roku 2004 v Nature Reviews Microbiology. Pochopení těchto složitých mikrobiálních struktur je aktivní oblastí výzkumu.
"Biofilmy jsou úžasné komunity. Někteří lidé je srovnávali s mnohobuněčnými organismy, protože mezi jednotlivými buňkami existuje mnoho interakcí," řekl Gerlach. "Stále se o nich učíme a stále se učíme o tom, jak je lépe ovládat; jak pro sníženou újmu, jako v oblasti medicíny, tak pro větší prospěch jako při bioremediaci. zajímavé otázky v této oblasti. “