Již dlouho je známo, že všechny molekuly mají dva stejné a opačné náboje, které jsou odděleny určitou vzdáleností. V případě takových polárních molekul se centrum záporného náboje neshoduje se středem kladného náboje. Rozsah polarity v takových kovalentních molekulách může být popsán termínem Dipole Moment, což je v podstatě míra polarity v polární kovalentní vazbě.
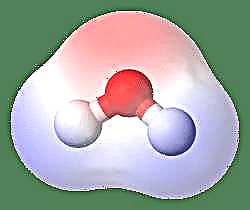
Nejjednodušším příkladem dipólu je molekula vody. Molekula vody je polární kvůli nerovnoměrnému sdílení jejích elektronů v „ohnuté“ struktuře. Molekula vody tvoří úhel s atomy vodíku na koncích a kyslíkem ve vrcholu. Protože kyslík má vyšší elektronegativitu než vodík, má strana molekuly s atomem kyslíku částečný záporný náboj, zatímco vodík ve středu má částečný kladný náboj. Z tohoto důvodu směr dipólového momentu ukazuje na kyslík.
V jazyce fyziky je elektrický dipólový moment měřítkem oddělení kladných a záporných elektrických nábojů v systému nábojů, tj. Mírou celkové polarity nábojového systému - tj. Separací elektrického náboje molekul, které vede k dipólu. Matematicky a v jednoduchém případě dvou bodových nábojů, jeden s nábojem + q a druhý s nábojem? Q, lze elektrický dipólový moment p vyjádřit jako: p = qd, kde d je vektor posunutí směřující od záporného náboje k kladný náboj. Proto vektor elektrického dipólového momentu p ukazuje od záporného náboje k kladnému náboji.
Dalším způsobem, jak se na to podívat, je reprezentovat Dipolový moment řeckým písmenem m, m = ed, kde e je elektrický náboj a d je vzdálenost oddělení. Je vyjádřena v jednotkách Debye a zapsána jako D (kde 1 Debye = 1 x 10-18e.s.u cm). Dipolový moment je množství vektoru, a proto je představováno malou šipkou s ocasem v kladném středu a hlavou směřující k zápornému středu. V případě molekuly vody je dipólový moment 1,85 D, zatímco molekula kyseliny chlorovodíkové je 1,03 D a může být reprezentována jako:
Napsali jsme mnoho článků o dipólovém okamžiku pro časopis Space Space. Zde je článek o tom, z čeho je voda vyrobena, a zde je článek o molekulách.
Pokud byste chtěli získat více informací o dipólovém okamžiku, podívejte se na tyto články od Hyperphysics and Science Daily.
Zaznamenali jsme také celou epizodu obsazení Astronomie Cast vše o Molecules in Space. Poslouchejte zde, Episode 116: Molecules in Space.
Zdroje:
http://en.wikipedia.org/wiki/Electric_dipole_moment
http://en.wikipedia.org/wiki/Dipole
http://www.tutorvista.com/content/chemistry/chemistry-iii/chemical-bonding/degree-polarity.php
http://hyperphysics.phy-astr.gsu.edu/hbase/electric/dipole.html#c1
http://en.wikipedia.org/wiki/Water_molecule