Začátek 20. století byl pro vědy velmi příznivým obdobím. Kromě Ernesta Rutherforda a Nielse Bohra, který porodil Standardní model částicové fyziky, to bylo také období průlomu v oblasti kvantové mechaniky. Díky pokračujícím studiím o chování elektronů začali vědci navrhovat teorie, podle kterých se tyto elementární částice chovaly způsobem, který vzdoroval klasické newtonské fyzice.
Jedním takovým příkladem je Electron Cloud Model navržený Erwinem Schrodingerem. Díky tomuto modelu již nebyly elektrony zobrazovány jako částice pohybující se kolem centrálního jádra na pevné oběžné dráze. Místo toho Schrodinger navrhl model, podle něhož by vědci mohli dělat jen vzdělané odhady ohledně postavení elektronů. Jejich umístění lze tedy popsat pouze jako součást „oblaku“ kolem jádra, kde je pravděpodobné, že budou nalezeny elektrony.
Atomová fyzika do 20. století:
Nejdříve známé příklady atomové teorie pocházejí ze starověkého Řecka a Indie, kde filozofové jako Demokritus předpokládali, že veškerá hmota byla složena z malých, nedělitelných a nezničitelných jednotek. Pojem „atom“ byl vytvořen ve starověkém Řecku a dal vznik škole myšlenek známé jako „atomismus“. Tato teorie však byla spíše filozofickým konceptem než vědeckým.
Teorie atomů se stala až vědeckou záležitostí až v 19. století, kdy byly provedeny první experimenty založené na důkazech. Například na začátku osmdesátých let použil anglický vědec John Dalton koncept atomu k vysvětlení toho, proč chemické prvky reagovaly určitými pozorovatelnými a předvídatelnými způsoby. Prostřednictvím řady experimentů s plyny Dalton pokračoval ve vývoji toho, co je známé jako Daltonova atomová teorie.
Tato teorie se rozšířila o zákonech konverzace hmoty a určitých proporcí a sestoupila do pěti prostor: prvky, v jejich nejčistším stavu, sestávají z částic nazývaných atomy; atomy specifického prvku jsou všechny stejné, až po poslední atom; atomy různých prvků lze rozeznat podle jejich atomových hmotností; atomy prvků se spojí a vytvoří chemické sloučeniny; atomy nemohou být vytvořeny ani zničeny chemickou reakcí, pouze seskupení se někdy mění.
Objev elektronů:
Koncem 19. století vědci také začali teoretizovat, že atom je tvořen více než jednou základní jednotkou. Většina vědců se však odvážila, že tato jednotka bude mít velikost nejmenšího známého atomu - vodíku. Koncem 19. století se jeho drasticky změní díky výzkumu prováděnému vědci, jako je Sir Joseph John Thomson.
Prostřednictvím série experimentů používajících katodové trubice (známé jako Crookesova trubice) Thomson pozoroval, že katodové paprsky mohou být vychylovány elektrickými a magnetickými poli. Došel k závěru, že místo toho, aby byly složeny ze světla, byly tvořeny negativně nabitými částicemi, které byly 1ooo krát menší a 1800krát lehčí než vodík.

Toto účinně vyvrátilo představu, že atom vodíku byl nejmenší jednotka hmoty, a Thompson šel dále navrhnout, že atomy byly dělitelné. Abychom vysvětlili celkový náboj atomu, který sestával z kladných i záporných nábojů, navrhl Thompson model, ve kterém byly záporně nabité „tělíska“ distribuovány do stejnoměrného moře pozitivního náboje - známého jako model slivového pudinku.
Tyto komplexy by později byly pojmenovány „elektrony“, založené na teoretické částici předpovídané anglo-irským fyzikem George Johnstoneem Stoneyem v roce 1874. Z toho se zrodil model slivového pudinku, který byl pojmenován, protože úzce připomínal anglickou poušť, která se skládá z švestkový koláč a rozinky. Koncept byl představen světu v březnu 1904 vydání Spojeného království Filozofický časopis, k širokému uznání.
Vývoj standardního modelu:
Následující experimenty odhalily řadu vědeckých problémů s modelem švestkového pudinku. Pro začátek byl problém prokázat, že atom měl jednotný pozitivní náboj na pozadí, který se stal známým jako „Thomsonův problém“. O pět let později by tento model vyvrátili Hans Geiger a Ernest Marsden, kteří provedli řadu experimentů s použitím alfa částic a zlaté fólie - aka. „experiment se zlatou fólií“.
V tomto experimentu Geiger a Marsden měřili rozptyl alfa částic pomocí fluorescenční obrazovky. Pokud by Thomsonův model byl správný, alfa částice by procházely atomovou strukturou fólie bez omezení. Namísto toho však poznamenali, že zatímco většina z nich byla přímá, některé byly rozptýleny různými směry, jiné se vracely ve směru zdroje.

Geiger a Marsden dospěli k závěru, že částice narazily na elektrostatickou sílu mnohem větší, než je síla, kterou umožňuje Thomsonův model. Protože alfa částice jsou jen jádra helia (která jsou kladně nabitá), znamenalo to, že kladný náboj v atomu nebyl široce rozptýlen, ale koncentrován v malém objemu. Navíc skutečnost, že ty částice, které nebyly odkloněny, prošly bez omezení, znamenalo, že tyto pozitivní prostory byly odděleny obrovskými zálivy prázdného prostoru.
1911, fyzik Ernest Rutherford interpretoval Geiger-Marsden experimenty a odmítl Thomsonův model atomu. Místo toho navrhl model, ve kterém atom sestával z převážně prázdného prostoru, se veškerým kladným nábojem soustředěným ve svém středu ve velmi malém objemu, který byl obklopen oblakem elektronů. To se stalo známým jako Rutherfordův model atomu.
Následné experimenty Antonia Van den Broeka a Nielse Bohra model dále vylepšily. Zatímco Van den Broek navrhoval, že atomové číslo prvku je velmi podobné jeho jadernému náboji, druhý navrhl model atomu podobný slunečnímu systému, kde jádro obsahuje atomové číslo kladného náboje a je obklopeno stejným počet elektronů v orbitálních nábojích (tzv. Bohrův model).
The Electron Cloud Model:
Během dvacátých let 20. století byl rakouský fyzik Erwin Schrodinger fascinován teoriemi Maxem Planckem, Albertem Einsteinem, Nielsem Bohrem, Arnoldem Sommerfeldem a dalšími fyziky. Během této doby se také zapojil do oborů atomové teorie a spektra, zkoumal na univerzitě v Curychu a poté na univerzitě Friedricha Wilhelma v Berlíně (kde v roce 1927 následoval Plancka).

V roce 1926 se Schrödinger zabýval otázkou vlnových funkcí a elektronů v řadě papírů. Kromě popisu toho, co by se stalo známým jako Schrodingerova rovnice - parciální diferenciální rovnice, která popisuje, jak se kvantový stav kvantového systému mění s časem - použil také matematické rovnice k popisu pravděpodobnosti nalezení elektronu v určité poloze .
Toto se stalo základem toho, co by se stalo známým jako Electron Cloud (nebo kvantový mechanický) model, stejně jako Schrodingerova rovnice. Na základě kvantové teorie, která uvádí, že veškerá hmota má vlastnosti spojené s vlnovou funkcí, se model Electron Cloud Model liší od modelu Bohr v tom, že nedefinuje přesnou cestu elektronu.
Místo toho předpovídá pravděpodobnou polohu umístění elektronu na základě funkce pravděpodobností. Funkce pravděpodobnosti v podstatě popisuje oblast podobnou cloudu, kde je pravděpodobné, že bude elektron nalezen, odtud název. Tam, kde je oblak nejhustší, je pravděpodobnost nalezení elektronu největší; a tam, kde je elektron méně pravděpodobný, je oblak méně hustý.
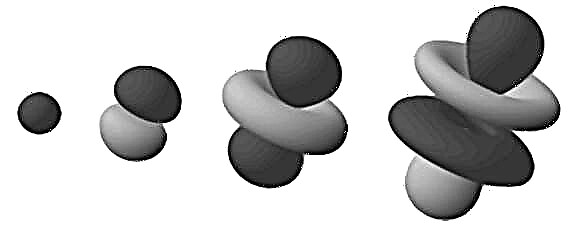
Tyto husté oblasti jsou známé jako „elektronové orbitaly“, protože jsou nejpravděpodobnějším místem, kde bude nalezen oběžný elektron. Při rozšíření tohoto „cloudového“ modelu na trojrozměrný prostor vidíme atomový činek nebo květ (jako na obrázku nahoře). Zde jsou oblasti, kde se větvují, ty oblasti, kde s největší pravděpodobností najdeme elektrony.
Díky Schrodingerově práci vědci začali chápat, že v oblasti kvantové mechaniky nebylo možné znát přesnou polohu a hybnost elektronu současně. Bez ohledu na to, co pozorovatel zpočátku ví o částici, může předvídat její budoucí umístění nebo hybnost pouze z hlediska pravděpodobností.
V žádném daném okamžiku nebudou schopni zjistit ani jeden. Ve skutečnosti čím více vědí o hybnosti částice, tím méně budou vědět o svém umístění a naopak. To je dnes známo jako „zásada nejistoty“.
Všimněte si, že orbitaly uvedené v předchozím odstavci jsou tvořeny atomem vodíku (tj. Pouze s jedním elektronem). Při práci s atomy, které mají více elektronů, se oběžné dráhy elektronů rovnoměrně rozprostřou do sférické fuzzy koule. Zde je termín „elektronový mrak“ nejvhodnější.
Tento příspěvek byl všeobecně uznáván jako jeden z nákladově důležitých příspěvků 20. století a příspěvek, který spustil revoluci v oborech fyziky, kvantové mechaniky a skutečně všech věd. Od té doby vědci již nepracovali ve vesmíru charakterizovaném absolutními časy a prostorem, ale v kvantových nejistotách a relativitě časoprostoru!
Zde jsme v Space Magazine napsali mnoho zajímavých článků o atomech a atomových modelech. Zde je Co je atomový model Johna Daltona ?, Co je to model slivového pudinku?
Pro více informací nezapomeňte zkontrolovat, co je kvantová mechanika? od Live Science.
Astronomie Cast má také epizodu na toto téma, jako je Epizoda 130: Radio Astronomy, Episode 138: Quantum Mechanics a Episode 252: Heisenberg Princip Neistota